1. 서 론
2. 광촉매 정의 및 기능
2.1 광촉매 정의
2.2 광촉매 기능과 용도
3. TiO2 광촉매
3.1 TiO2 특징
3.2 TiO2 결정과 제조
3.3 TiO2 광촉매 반응
4. 광촉매포장의 대기정화 효과
5. 결 론
1. 서 론
광촉매의 연구는 1972년 Fujishima와 Honda가 TiO2 전극으로 물을 광분해시켜 수소를 제조하는 것으로 시작하여 현재는 환경오염 물질의 분해 및 자정, 향균 기능 등을 응용하여 코팅소재로서 연구가 확대되어왔다(Fujishima and Honda, 1972; Hoffmann et al., 1995; Choi et al., 2001; Wang et al., 1997; Sunada et al., 1998). 특히 건축 및 토목분야에서는 광촉매 분말을 사용한 시멘트 콘크리트와 광촉매포장이 적용, 연구되고 있다(J. H. Jeong et al., 2010; MOLIT, 2004; Kim et al., 2003; Choi et al., 2002; Lee and Park., 2010; Park et al., 2017). 광촉매코팅의 재료로서 이산화티타늄(Titanium Dioxide, TiO2)이 주로 사용되는데, 광촉매코팅의 원리와 시공방법, 효과를 이해하기 위해서는 TiO2의 구조와 제조, 특징에 대한 이해가 필요하다. 본 연구는 광촉매의 정의 및 기능을 설명하고, TiO2의 광촉매 반응을 소개함으로서 문헌연구차원에서 도로포장분야에 광촉매를 적용시키는 데 이바지하고자 한다.
2. 광촉매 정의 및 기능
2.1 광촉매 정의
모든 물질은 동일한 원자 또는 분자 단위의 전자들이 서로 가까운 거리에서 영향을 주고받아 각 전자의 에너지들이 촘촘하게 밀집되어 있어 거의 연속적으로 띠처럼 형성되어 있는데 이것을 에너지밴드(Energy Band)라 한다. 각 에너지 밴드는 전자들이 보유한 고유 에너지와 운동량에 따라 분산관계를 이루게 되어 각 에너지 밴드 사이에 간격이 발생하게 되고 이를 밴드(Band Gap)이라 한다. Fig. 1은 도체와 반도체, 부도체를 묘사한 것이다(Tutorialspoint, 2021). 에너지 밴드와 에너지 갭의 간격에 따라 도체, 반도체, 부도체로 나뉘게 된다. 도체는 가전자대(Valance Band, VB)와 전도대(Construction Band, CB)에 겹쳐져 있어 전자이동이 원할하여 전류가 잘 흐르나 부도체는 밴드 갭(Band gap)이 너무 커서 가전자대에서 전도대로의 전자전이가 어려워 전류가 흐르기 어렵다. 반면에 반도체는 절연체에 비해 밴드 갭(Band gap)이 작아서 밴드 갭(Band gap)의 에너지를 초과하는 에너지에 의해 전자전이가 일어나 전류가 흐를 수 있다. 광촉매는 반도체의 성질을 띠는 촉매로서 빛을 에너지원으로 하는 촉매를 의미한다. 빛에 의해 전도대 내 전자를 가전자대로 여기(Exciatation)시키고 이때 생성된 전하쌍이 계면으로 이동하여 전자 전이를 일으키고, 표면에 하이드록시 라디칼(Hydroxyl Radical), 초과산화물 라디칼(Superoxide Radical) 등 활성산소를 생성하여 다양한 종류의 산화, 환원 반응을 유도한다(Choi, 2003; Choi and Lee, 2005).
2.2 광촉매 기능과 용도
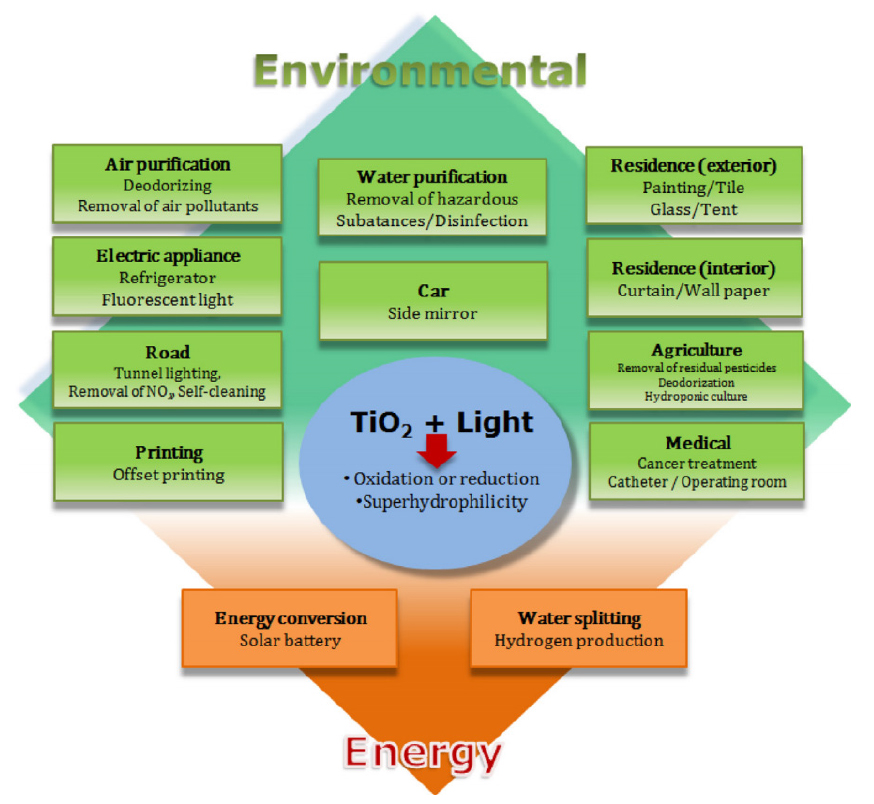
광촉매 기능은 유기물 산화 및 분해, 향균, 탈취, 친수성, 정수, 자외선 차단 등으로 요약할 수 있다. 광촉매에 빛이 닿으면 활성산소가 발생하여 유해균 및 유해가스 등 생활환경에 존재하는 유해물질의 분자를 분해하고, 납과 수은 등 중금속을 산화 및 침전시켜 제거할 수 있다. Fig. 2는 광촉매의 대표적인 물질인 TiO2의 용도를 나타낸 것이다(Lee and Park, 2013). 환경분야에서는 광촉매가 코팅된 허니컴과 자외선 램프로 대기중이나 수중에 오염된 유기화합물을 분해하는데 사용되고, 건축자재 분야에서는 내벽 및 외벽, 타일 및 욕조등에 광촉매 코팅자재를 사용함으로서 표면을 오염시키는 유기물을 산화분해시켜 외부 오염물질이나 곰팡이를 예방하며 탈취작용을 한다. 자동차 분야에서는 내부 탈취제나 발수코팅재로서 김서림 방지나, 물로 인한 시야방해를 방지한다. 도로포장 분야에서는 터널내벽, 도로 가드레일, 도로 표지판, 방음벽 등에 광촉매를 코팅하여 외부 오염을 방지시킨다. 가전 분야에서는 공기정화기, 에어컨 필터 등으로 사용되며, 냉장고 내부에 광촉매 코팅을 함으로서 냄새를 탈취할 수 있다(Lee and Park, 2013; KEITIC, 2004, 2019; KOITA, 2004). 이처럼 광촉매를 응용한 분야는 다양하고 광범위하다.
3. TiO2 광촉매
3.1 TiO2 특징
광촉매로서 사용할 수 있는 촉매로는 ZnO, CdS, ZrO2, SnO2, V2O2, WO3 등과 금속산화물(SrTiO3, KTaQ3) 등이 있으나 ZnO나 CdS는 빛을 흡수하는 과정에서 촉매 자체가 분해되어 Zn 이온과 Cd 이온을 발생시키고, WO3는 특정 물질에서만 광촉매로서 효율이 좋다. TiO2는 빛을 흡수하여도 성분이 변하지 않아 반 영구적으로 사용할 수 있으며 광촉매 반응에 의한 산화물 반도체의 활성은 TiO2 > ZnO > ZrO2 > SnO2, > V2O3 순으로 가장 좋다(Choi, 2003). TiO2는 구하기 쉽고, 합성이 쉬워 대량 생산이 가능하며, 분말 또는 액체상태의 콜로이드 분산이 가능하기 때문에 표면 코팅재료로서 적용이 용이하다. 그리고 화학적으로 안정하고 무독성이기 때문에 열화현상이 발생하지 않고, 산과 알칼리에 강한 저항력을 가지고 있다(Liu et al., 2013; Pinho and Mosquera, 2013).
3.2 TiO2 결정과 제조
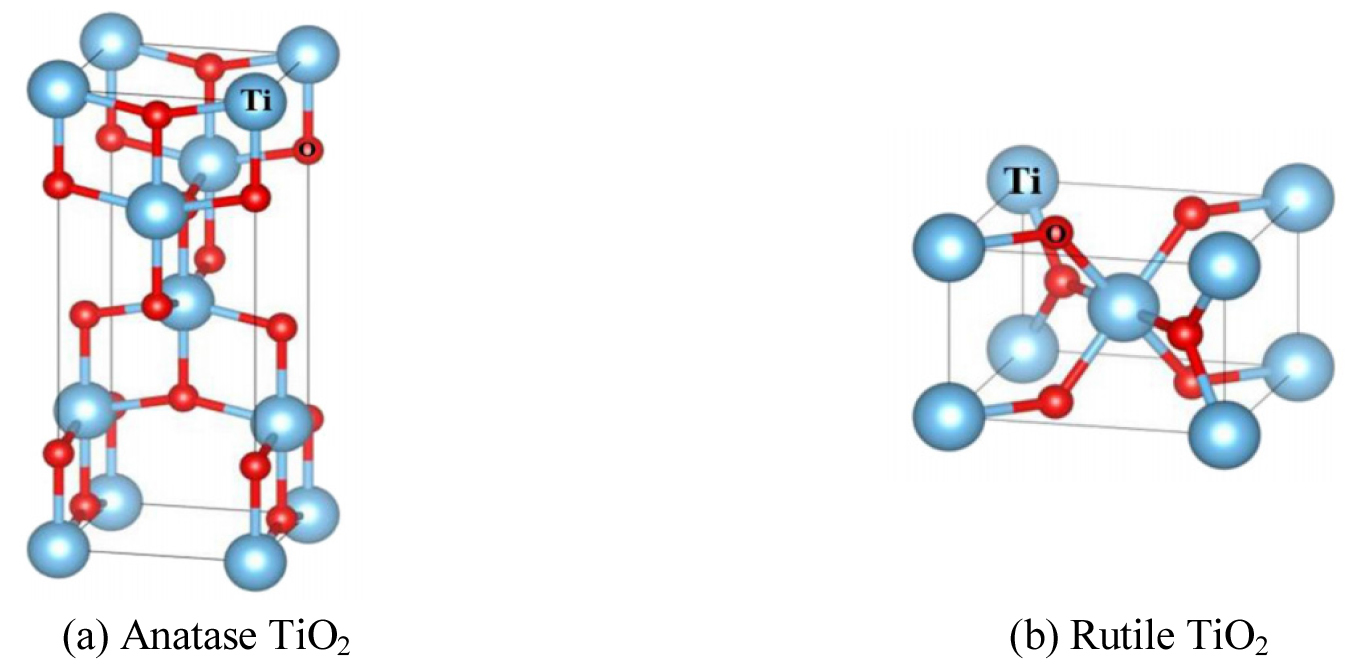
Fig. 3 및 Table 1은 TiO2의 결정과 결정별 특징을 요약한 것이다(Jia et al., 2016; Jang and Kim, 2000; Jeong, 2000). TiO2의 결정은 정방정계이지만 아나타제(Anatase) 형은 4개의 TiO2원자를 가지고 있고, 루틸(Rutile)형은 2개의 TiO2원자를 가지고 있다. 아나타제형은 자연적인 결정형태 중 드물게 존재하며, 약 915°C 이상에서 루틸형으로 변화한다. 광촉매 활성이 가장 강한 특징이 있다. 루틸형은 가장 일반적인 형태로서 SnO2와 동일한 분자구조를 가지고 있으며, 백색의 고체로 안료나 페인트의 원료로 사용된다(Jeong, 2000).
TiO2는 티타늄이 포함된 광석에서 제조할 수 있는데, 황산용액과 반응시켜 제조하는 황산법과 염소가스와 반응하여 제조하는 염소법이 있다(Jang and Kim, 2000). 광촉매용 TiO2 제조에는 주로 염소법이 사용되며 염소법은 염화반응공정과 산화반응공정으로 분류할 수 있다. (1) 및 (2)는 염화반응공정과 산화반응공정의 반응식을 나타낸 것이다. 티타늄 원석(루틸광)을 1000°C 정도의 고온에서 염소가스와 반응시켜 TiCl4을 만들고, TiCl4을 고온에서 산소와 반응시켜 TiO2를 생성시킨다. 염소법에 의해 생성된 TiO2는 분말의 일차입자 크기가 약 20 nm이며 주로 아나타제형의 결정이 된다.
Table 1.
The crystal types of TiO2 (Jang and Kim, 2000; Jeong, 2000)
| Anatase | Rutile | |
| Density | 3.90 g/cm3 | 4.27 g/cm3 |
| Refractive index | 2.52 | 2.71 |
| Band gap energy | 3.23 eV | 3.02 eV |
3.3 TiO2 광촉매 반응
Fig. 4는 TiO2의 광촉매 반응 도식화 한 것이다(Lee and Park, 2013). TiO2의 광촉매 반응은 정공에 의한 직접반응과 OH 라디칼을 통한 간접적 반응으로 광촉매반응이 진행된다. (3) ~ (13)은 공정별 반응식을 나타낸 것이다(Choi, 2003; Choi and Lee, 2013; Jang and Kim, 2000; Jeong, 2000; An et al., 2016). TiO2는 n형 반도체로서 밴드 갭(Band Gap) 에너지을 초과하는 일정한 영역의 에너지(3.2 eV이상, 400 nm 이하의 파장) 받으면 가전자대(Valance Band, VB)에서 전도대(Conduction Band, CB)로 (-)의 전자를 여기(Exciatation)시키게 되고 가전자대에 기존의 전자가 빠져나가 (+)의 정공(Positive Hole, H+)이 형성된다((3)).
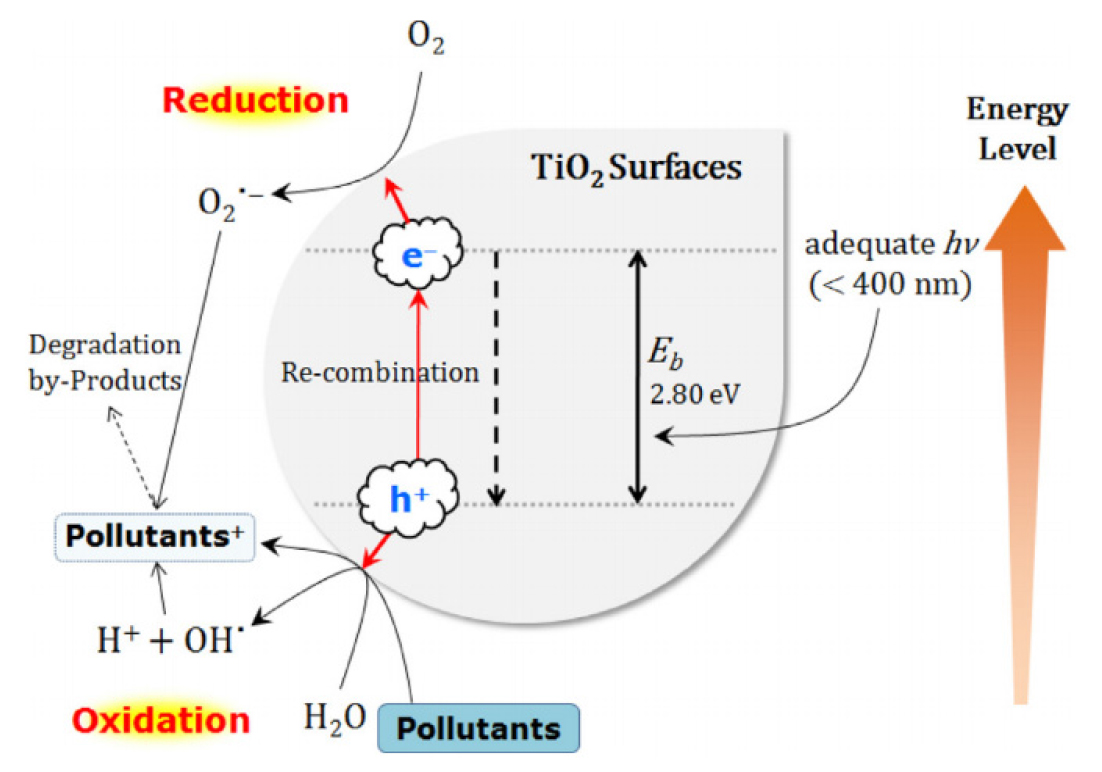
Fig. 4.
Schematic illustration on removal of pollutants by the formation of photoinduced charge carriers (e/h+) in a semiconductor TiO2 particle surfaces (Lee and Park, 2013)
전도대의 여기된 전자는 외부와의 접촉 등으로 산란하여 에너지를 전달한 뒤 전도대 하단에 접근하여 머무르게 되고((4)~(5)), 전자의 위치 에너지(potential energy)가 낮아져 열을 방출하면서 정공으로 재결합이 발생한다((6)). 이 과정에서 표면에 흡착된 산소 또는 물과 여기된 전자와 정공이 각각 반응하여 활성산소(Super Oxide Anion,O2●-)와 수산화기(OH●)를 생성한다. 여기된 전자로 인해 여기상태(excited state)가 된 전도대에서는 전자의 환원반응으로 공기 중 산소의 환원이 일어나 활성산소를 생성하고, 가전자대의 정공에서는 물과 반응하여 수산기를 생성한다((7), (8), (9), (10)). 수산화기의 생성은 TiO2의 광촉매 반응으로 발생하는 산화력의 핵심으로서 높은 산화, 환원 전위를 가지고 있기 때문에 NOx, SOx, 휘발성 유기화합물(VOCs) 및 각종 악취 정화에 탁월하고, 축산폐수, 오수, 공장폐수의 BOD, 색도 및 난분해성 오염물질, 환경호르몬 등을 완벽히 제거할 수 있을 뿐만 아니라, 병원성대장균, 황색포도구균, 등 각종 병원균과 박테리아를 살균할 수 있다. TiO2 광촉매는 태양에너지 또는 형광빛에 의해서도 반응이 일어나며, 「물체에의 정착→광분해→재결합」의 사이클에 의해 연속적으로 기능을 발휘할 수 있는 장점이 있다(KEITIC, 2004).
4. 광촉매포장의 대기정화 효과
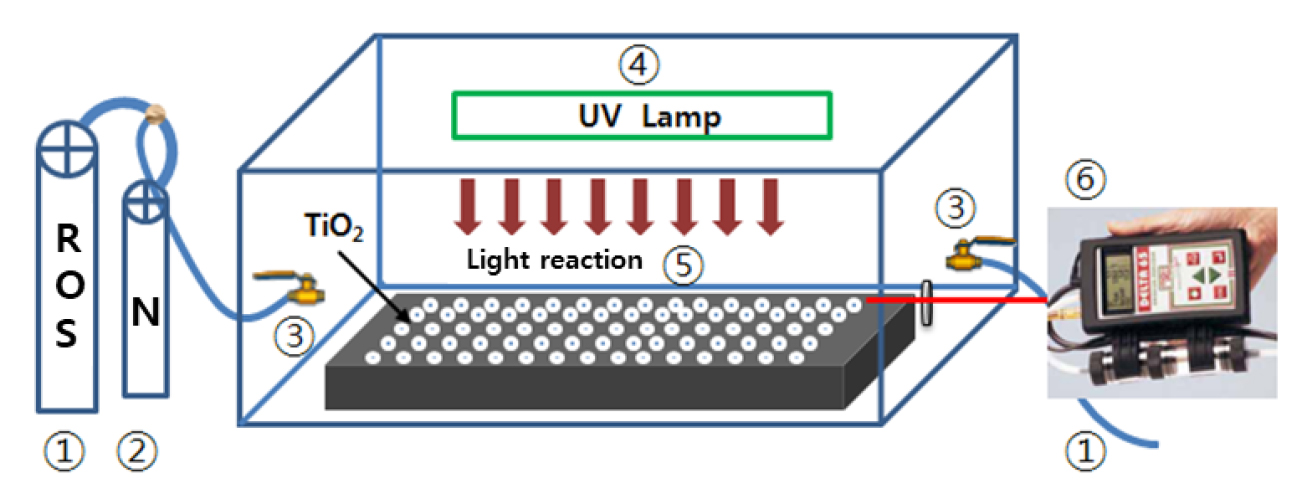
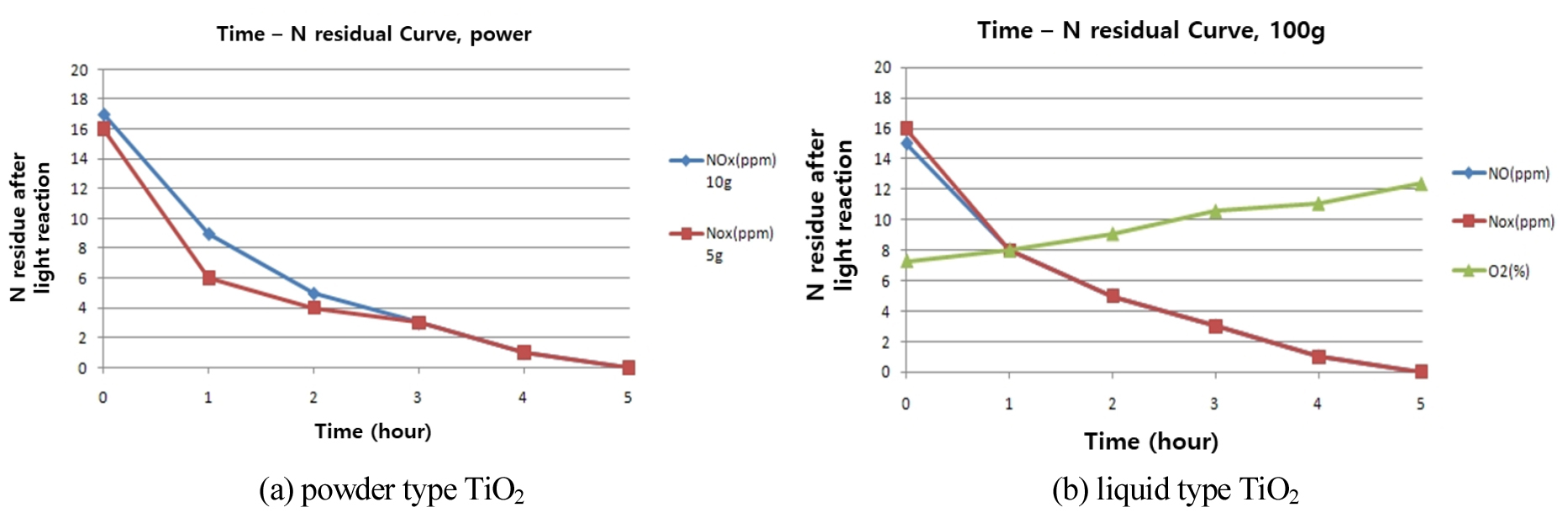
Lee and Park (2010)은 아스팔트 시편에 분말형태와 액상형태의 TiO2 광촉매를 아스팔트 시편에 적정량(분말형태 5 g 및 10 g, 액상형태 100 g)으로 코팅한 뒤 밀폐식 질소산화물 처리 장치를 사용하여 초기 질소가스를 16 ppm으로 주입한 후 1시간 단위로 장치 내 질소가스량을 측정하였다(Lee and Park, 2010). Fig. 5는 밀폐식 질소산화물 실험장치 개요도를 도식한 것이다. 시험결과 분말형태와 액상형태 모두 질소가스를 주입 후 1시간 경과되었을 때 잔류질소가스는 50% 가량 감소하였으며, 5시간 후에 잔류질소산화물은 모두 제거되어 대기정화 효과를 확인하였다(Fig. 6).
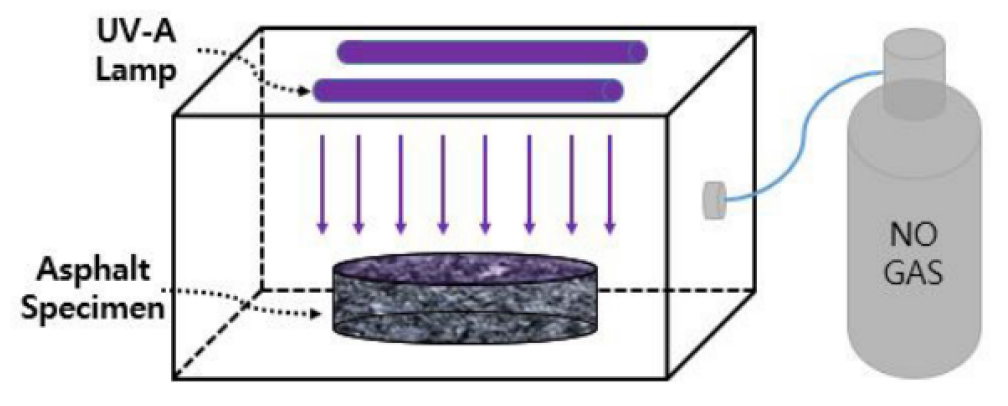
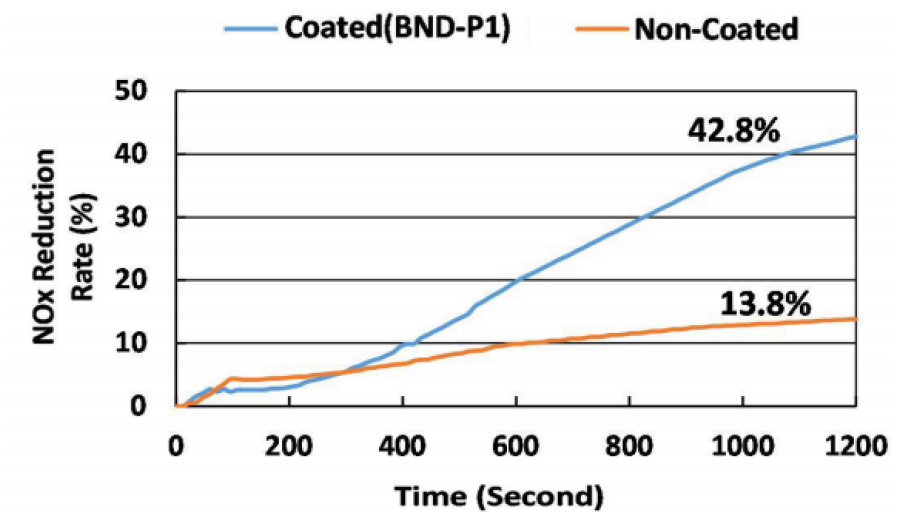
Park et al. (2017)은 10 cm × 10 cm × 5 cm 크기의 아스팔트 시편에 1액형 TiO2 광촉매를 분사한 후 질소가스 제거 시험을 통해 질소가스 저감률을 계산하였다(Park et al., 2017). UV-A 광원이 설치된 챔버에 시료를 넣어 농도 20 ppm의 NO 가스와 N2 가스를 주입 후 1,200초 동안 측정을 진행하였다(Fig. 7). 시험결과 1,200초 후 Fig. 8과 같이 광촉매를 사용하지 않은 일반 아스팔트 시편은 실험 가스가 아스팔트 혼합물 공극 내로 일부 흡수되어 약 13.8% 가량 저감되었고, 1액형 TiO2 광촉매를 분사한 아스팔트 시편은 42.8%의 질소산화물(NOx)이 분해됨을 확인하여 질소산화물(NOx)를 저감시키는 특성을 확인하였다.